4:不同濃度的硝酸與鋅碳電池內的氧化還原反應
這就是最後一節了,今次分別要說2個主題,分別是:
a)不同濃度的硝酸作為氧化劑
b)鋅碳電池內的氧化還原反應
a)不同濃度的硝酸作為氧化劑
之前,你們有沒有學習稀酸的性質這一章節嗎? 我們從這章中可以知道極稀硝酸才具有一般酸的特性。而稀硝酸和濃硝酸都是強氧化劑。它們可把大部份金屬氧化,並包括在電化序中位置低於氫的金屬(如:銅,汞)。
首先,看看濃硝酸作為氧化劑:
試觀察濃硝酸與銅的反應。
在反應過程中,硝酸根離子(NO3-
)被還原為二氧化氮(NO2)。氮的氧化數為+5降至+4。
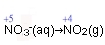
表示硝酸根離子的還原作用的離子半反應式:
表示銅的氧化作用的離子半反應式:
把上述兩個離子半反應式合併,便會得出濃硝酸與銅的氧化還原反應的平衡方程式:
濃硝酸具腐蝕性,因它有很強的還原能力。不過,要注意的是二氧化氮具有毒性和腐蝕性。
再看看稀硝酸作為氧化劑。
在反應過程中,硝酸根離子(NO3-
)被還原為一氧化氮(NO)。氮的氧化數由+5降至+2。
![]()
表示硝酸根離子的還原作用的離子半反應式:
表示銅的氧化作用的離子半反應式:
把上述兩個離子半反應式合併,便會得出稀硝酸與銅的氧化還原反應的平衡方程式:
一氧化氮(NO)是一種無色氣體。這氣體與空氣混合時,會與空氣中的氧反應,生成棕色的氣體-二氧化氮(NO2)。
(試把滑鼠移至圖上)
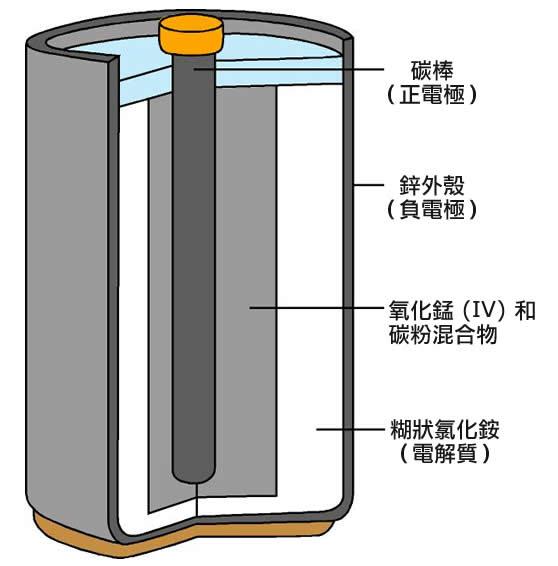
b)鋅碳電池內的氧化還原反應
鋅碳電池內有一支被氧化錳(IV)和碳粉混合物所包圍的碳棒,這碳棒是正電極。而電池的外殼由鋅所組成,是負電極。電解質為濕潤的糊狀氯化銨。以下兩圖為展示鋅碳電池內的構造。
(左)圖11:鋅碳電池的內部結構
(右)圖12:被切為一半的鋅碳電池
在負電極上發生的氧化作用:
Zn(s)→Zn2+(aq)+2e-
鋅釋放的電子會經外電路流到正電極。
在正電極上發生的還原作用:
2NH4+(aq)+2e-→2NH3(aq)+H2(g)
在上述反應過程中,氫氣會在正電極周圍積聚。由於氫的導電性能是很差的,積聚在正電極周圍的氫氣會阻礙反應繼續進行,而令到電流減少。因此必須要把電池加入氧化錳(IV)這氧化劑來去除氫氣。
2MnO2(s)+H2(g)→Mn2O3(s)+H2O(l)
鋅離子則與氨反應。
Zn2+(aq)+2NH3(aq)+2Cl-(aq)→Zn(NH3)2Cl2(s)
電池內的整體反應:
2MnO2(s)+2NH4Cl(aq)+Zn(s)→Zn(NH3)2Cl2(s)+Mn2O3(s)+H2O(l)
但鋅碳電池至少有兩個缺點:
1)如電池放電太快,便因它不能及時除去生成的氣體,而使電壓被降低。
2)由於鋅電極與銨離子之間會有一種緩慢反應,因此鋅碳電池的貯存期也較短。這種電池經過一段時間後,鋅外
殼便會變薄,電池內的糊狀化學品便會泄漏出來。